Índice
- 🔬 Introdução: A Força da Química para a Limpeza Pesada
- ⚗️ Como Funcionam os Agentes Oxidantes na Limpeza? A Magia da Reação!
- ⚡ E os Agentes Redutores? O Contraponto na Química da Limpeza
- 🎯 Exemplos de Redutores na Limpeza:
- 🧪 Por Que Oxidantes São Tão Poderosos na Limpeza?
- ⚠️ Limitações e Cuidados Essenciais 🛡️
- 🌱 Tendências Verdes nos Oxidantes: Limpeza Mais Sustentável ♻️
- 📌 Conclusão
- 📚 Bibliografia
- Glossário:
🔬 Introdução: A Força da Química para a Limpeza Pesada
Quando pensamos em limpeza pesada — aquela que remove manchas difíceis, desinfeta profundamente ou branquia tecidos —, é impossível ignorar o papel crucial dos agentes oxidantes e redutores.
Esses compostos químicos são ferramentas poderosas para quebrar moléculas complexas, eliminar pigmentos, neutralizar odores e até destruir micro-organismos que outras substâncias não conseguem combater sozinhas.
Diferente das enzimas, que agem como “tesouras” biológicas em moléculas específicas, ou dos surfactantes, que facilitam a remoção da sujeira, os oxidantes trabalham de uma forma mais ampla e transformadora.
Eles promovem reações químicas que alteram a própria estrutura das sujidades orgânicas, tornando-as inertes, incolores, inodoras ou facilmente solúveis. É a química atuando em sua forma mais potente para a higiene e desinfecção.
⚗️ Como Funcionam os Agentes Oxidantes na Limpeza? A Magia da Reação!
No cerne da ação dos oxidantes está o processo de oxidação.
🔥 Oxidação na prática:
A oxidação consiste, quimicamente, na remoção de elétrons de uma molécula. Na limpeza, isso se traduz em um ataque direto às ligações químicas em compostos orgânicos. Ao romper essas ligações, os oxidantes conseguem quebrar cadeias de carbono ou destruir grupos funcionais que são responsáveis por dar cor, odor, ou a característica de aderência à sujeira.
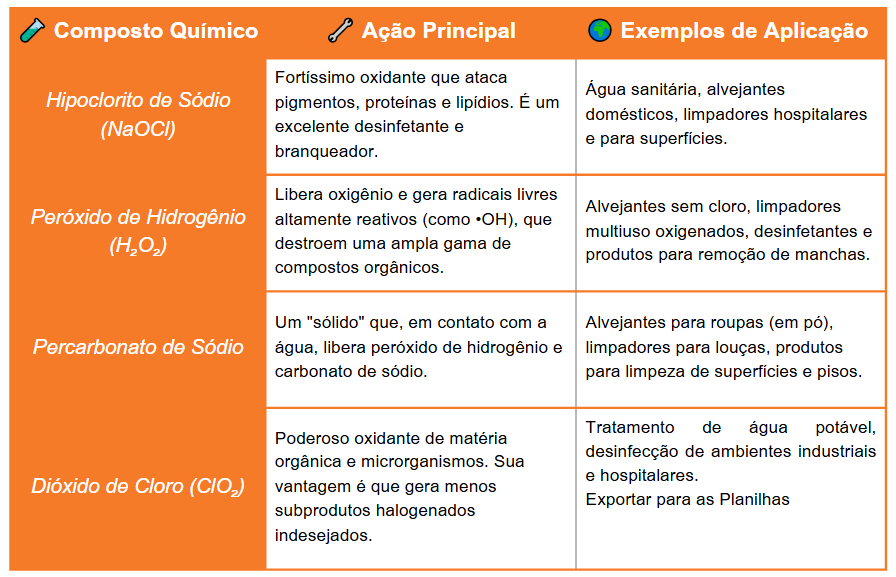
🌟 Os Principais Oxidantes em Produtos de Limpeza e Suas Aplicações:
👉 Mecanismo Detalhado:
Os oxidantes são mestres em atacar áreas específicas de moléculas orgânicas, como duplas ligações carbono-carbono (C=C), cadeias aromáticas, grupos sulfídricos (R-S-H) e aminas (R-NH₂). Ao quebrar essas estruturas, eles transformam a sujeira em compostos menores, que são então facilmente removidos, ficam incolores ou se tornam solúveis em água.
⚡ E os Agentes Redutores? O Contraponto na Química da Limpeza
Enquanto os oxidantes removem elétrons de outras moléculas, os agentes redutores fazem o oposto: eles doam elétrons, revertendo processos de oxidação.
Embora sejam menos comuns na limpeza do dia a dia, sua ação é extremamente útil e específica em certas situações, como:
– Remoção de manchas de ferrugem (que são óxidos de ferro).
– Neutralização de resíduos de cloro após processos de desinfecção.
– Desoxidação de superfícies metálicas.
🎯 Exemplos de Redutores na Limpeza:
– Metabissulfito de Sódio: Usado para neutralizar o excesso de cloro em efluentes ou superfícies, especialmente em processos industriais.
– Ácido Oxálico: Um ácido orgânico eficaz na remoção de manchas de ferrugem em tecidos, pedras e metais.
– Hidrossulfito de Sódio: Amplamente utilizado na indústria têxtil para branqueamento e desoxidação de tecidos, restaurando a cor original.
🧪 Por Que Oxidantes São Tão Poderosos na Limpeza?
A versatilidade e a força dos oxidantes os tornam indispensáveis:
✅ Versatilidade: Atuam em uma ampla gama de sujidades orgânicas, incluindo mofo, bolor, manchas complexas, e odores persistentes.
✅ Desinfecção Eficaz: Sua capacidade de destruir micro-organismos é notável. Eles oxidam membranas celulares, proteínas e ácidos nucleicos, eliminando bactérias, vírus e fungos.
✅Branqueamento: São campeões na remoção de pigmentos orgânicos que causam manchas em tecidos e superfícies, restaurando a cor original.
✅ Remoção de Odores: Oxidam e neutralizam os compostos voláteis que são responsáveis por odores desagradáveis, em vez de apenas mascará-los.
⚠️ Limitações e Cuidados Essenciais 🛡️
Apesar de seu poder, é crucial usar oxidantes com sabedoria, pois eles podem:
– Danos: Ser altamente reativos e potencialmente danificar tecidos delicados, certos metais (corroer), pedras naturais e superfícies sensíveis. Sempre teste em uma área discreta.
– Subprodutos: Oxidantes como o hipoclorito de sódio (cloro) podem liberar subprodutos tóxicos, como trihalometanos (THMs), quando reagem com matéria orgânica. O uso consciente e a ventilação são importantes.
– Incompatibilidade com Enzimas: Oxidantes inativam e destroem as enzimas. Por isso, eles nunca devem ser usados simultaneamente na mesma formulação ou etapa de limpeza. Em processos industriais, são utilizados em etapas distintas para maximizar a eficácia de ambos.
🌱 Tendências Verdes nos Oxidantes: Limpeza Mais Sustentável ♻️
A indústria da limpeza está em constante evolução, buscando alternativas mais seguras e sustentáveis para os oxidantes tradicionais:
– Peróxidos Estabilizados: Formulações avançadas que liberam oxigênio de forma controlada, garantindo eficácia com menor agressividade e maior segurança.
– Dióxido de Cloro (ClO₂): Ganhando destaque por sua alta eficiência e por não gerar os subprodutos halogenados indesejados associados ao cloro.
– Combinações Inteligentes: Formulações que combinam oxidantes suaves com enzimas e quelantes em diferentes etapas ou proporções, visando reduzir o impacto ambiental sem comprometer a eficácia da limpeza.
📌 Conclusão
Os agentes oxidantes são verdadeiras potências químicas na limpeza, atuando onde enzimas e tensoativos nem sempre conseguem alcançar.
Eles são insubstituíveis na destruição de compostos pigmentados, na eliminação de micro-organismos e na remoção de resíduos orgânicos altamente aderentes.
Compreender seu mecanismo de ação permite um uso mais inteligente, eficiente e, acima de tudo, seguro, tanto na limpeza doméstica quanto em aplicações industriais e hospitalares.
No equilíbrio entre a biotecnologia avançada, a química tradicional e a busca pela sustentabilidade, os oxidantes continuam sendo uma ferramenta indispensável — desde que aplicados com conhecimento e responsabilidade.
📚 Bibliografia
McDonnell, G., & Russell, A. D. (1999). Antiseptics and disinfectants: Activity, action, and resistance. Clinical Microbiology Reviews, 12(1), 147–179.
Block, S. S. (2001). Disinfection, Sterilization, and Preservation. Lippincott Williams & Wilkins.
Novozymes. (2023). Technical Review: Interactions Between Oxidants and Enzymes in Detergent Formulations. (Disponível em seus materiais técnicos ou artigos publicados).
Van Dijk, C. (2022). Green Chemistry in Cleaning Products: Innovations in Oxidative Cleaning. Journal of Cleaner Production, 350, 131452.
ASTM International. (2021). Standard Practices for Evaluating Cleaning Performance of Products Using Organic Soil. (Consulte as normas ASTM relacionadas à performance de limpeza).
Glossário:
Agentes Oxidantes (Oxidantes): Compostos químicos que atuam na limpeza removendo elétrons de outras moléculas (processo de oxidação), quebrando ligações químicas e transformando sujidades orgânicas em substâncias inertes, incolores, inodoras ou solúveis.
Oxidação: Processo químico central na ação dos oxidantes, onde uma molécula perde elétrons. Na limpeza, isso resulta na quebra das ligações químicas de sujeiras e pigmentos.
Reações Químicas: Processos que alteram a estrutura molecular das substâncias. Os oxidantes promovem reações químicas que quebram as sujidades.
Sujidades Orgânicas: Sujeiras de origem biológica ou baseadas em carbono (gorduras, proteínas, pigmentos, microrganismos), que são o principal alvo dos agentes oxidantes.
Hipoclorito de Sódio (NaOCl): Um dos oxidantes mais comuns e fortes, presente em água sanitária e alvejantes domésticos. É um potente desinfetante e branqueador, atacando pigmentos, proteínas e lipídios.
Peróxido de Hidrogênio (H₂O₂): Oxidante que libera oxigênio e gera radicais livres altamente reativos, capazes de destruir uma ampla gama de compostos orgânicos. Utilizado em alvejantes sem cloro, limpadores oxigenados e desinfetantes.
Radicais Livres (Hidroxila •OH): Moléculas altamente reativas e instáveis geradas por alguns oxidantes (como o peróxido de hidrogênio), que atacam e destroem compostos orgânicos.
Percarbonato de Sódio: Um oxidante sólido que, em contato com a água, libera peróxido de hidrogênio e carbonato de sódio. Comum em alvejantes para roupas em pó e limpadores.
Dióxido de Cloro (ClO₂): Oxidante poderoso para matéria orgânica e microrganismos, com a vantagem de gerar menos subprodutos halogenados indesejados. Usado em tratamento de água potável e desinfecção.
Agentes Redutores (Redutores): Compostos químicos que doam elétrons, revertendo processos de oxidação. São úteis na limpeza para remover manchas de ferrugem e neutralizar resíduos de cloro.
Manchas de Ferrugem: Manchas causadas por óxidos de ferro, que podem ser removidas por agentes redutores como o ácido oxálico.
Subprodutos Halogenados (THMs): Compostos que podem ser formados quando oxidantes à base de cloro (como hipoclorito de sódio) reagem com matéria orgânica, sendo preocupantes para a saúde e o ambiente.
Incompatibilidade com Enzimas: A propriedade dos oxidantes de inativar e destruir as enzimas. Por isso, eles devem ser usados em etapas distintas em processos de limpeza para otimizar a eficácia de ambos.
Surfactantes: Compostos que reduzem a tensão superficial da água, facilitando a penetração da solução de limpeza na sujeira e ajudando a emulsificar. Atuam em sinergia com oxidantes e quelantes.
Agentes Quelantes: Compostos que se ligam a íons metálicos (como cálcio e magnésio) em água dura, prevenindo incrustações e garantindo que os oxidantes atuem com máxima performance.
Limpeza Enzimática: Processo de limpeza que utiliza enzimas para quebrar sujeiras específicas. É diferente da limpeza oxidativa e geralmente ocorre em etapas separadas.
Peróxidos Estabilizados: Formulações mais avançadas de oxidantes (como o peróxido de hidrogênio) que liberam oxigênio de forma controlada, resultando em eficácia com menor agressividade e maior segurança.
Biotecnologia na Limpeza: Aplicação de princípios biológicos e organismos (como enzimas) ou seus derivados para desenvolver soluções de limpeza mais eficientes e sustentáveis.